La configuración electrónica se define como la combinación de los estados cuánticos de un átomo y como se representa la distribución de los electrones en los diferentes orbitales en las capas principales y subcapas
La configuración electrónica permite entender la formación de los enlaces químicos que forman a las sustancias químicas a partir de reacciones químicas.
El llenado de estos orbitales se produce en orden creciente de energía, es decir, desde los orbitales de menor energía hacia los de mayor energía.
¿Para qué sirve la configuración electrónica?
Mapa del artículo
Esta sirve para conocer cómo se distribuyen los electrones en cada elemento existente, para lograr obtener el conocimiento y saber cuáles elementos serían más fáciles de fusionar y saber cómo ubicar esos en los distintos niveles de energía y respetar la capacidad máxima de electrones de cada subnivel.
Reglas de la configuración electrónica
La configuración electrónica permite entender la formación de los enlaces químicos que forman a las sustancias químicas a partir de reacciones químicas.
Se basa en tres reglas o principios que rigen la configuración electrónica:
1- Principio de exclusión de Pauli
En un mismo átomo no pueden existir dos electrones con sus cuatro números cuánticos iguales.
Establece que un máximo de dos electrones pueden ocupar un mismo orbital atómico, pero si los electrones tienen espines opuestos.

Ejemplo, si se tienen dos electrones en el mismo subnivel, 2px, sus números cuánticos de espín deben ser diferentes: +1/2 y – 1/2, ya que n, l y ml son iguales para ambos electrones (2, 1 y – 1); es decir, (2, 1, -1, +1/2) y (2, 1, -1, -1/2).
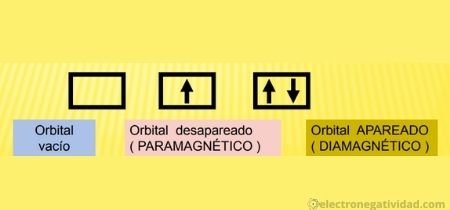
Un orbital atómico puede tener un máximo de dos electrones, los cuales deben tener signos contrarios para sus números cuánticos de espín y tendrán valores electronegativos distintos.
Se tienen los siguiente tipos de orbitales:
2-Principio de AUFBAU
El llenado de los subniveles energéticos se efectúa desde los que tienen menor energía hacia los de mayor energía.
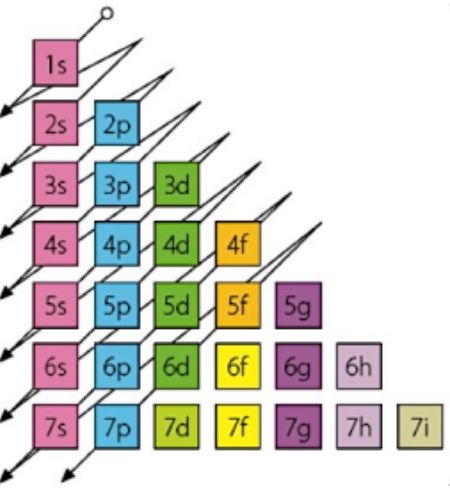
Es decir, rige el orden de llenado de los diferentes niveles y subniveles. Primero se llenan los orbitales de menor energía y después los de mayor energía.
Excepciones a esta regla: Cu, Ag, Au, La
Se utiliza el Diargama de Moeller, es un esquema simplificado que ayuda a ubicar los electrones en niveles y subniveles en orden de energía creciente. Se le conoce también como la regla de SARRUS y comúnmente denominada “regla del serrucho”.
3- Principio de máxima multiplicidad de Hund
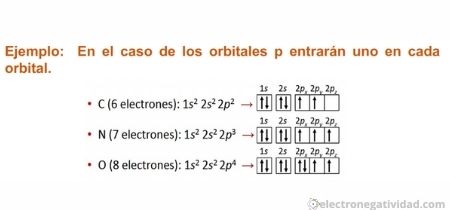
Los electrones, al ocupar un subnivel, se distribuyen en el mayor número posible de orbitales de forma que sus espines sean paralelos (máxima multiplicidad o desapareamiento máximo). Al ocupar diferentes orbitales, los electrones permanecen tan alejados uno de otro como es posible, minimizando las repulsiones electrón-electrón.
Orden energético de los subniveles
Cuando dos subniveles tienen la misma Er, sus orbitales son denominados “degenerados”.
En este caso, el subnivel que pertenece al mayor nivel, es el de mayor energía (menos estable). Ejemplo. 2s, 3p, 4s , 5f, 2p ,3d,
Siempre hay que ordenarlos de menor a mayor e identificar cuáles son degenerados.
El subnivel s aloja un máximo de 2 electrones.
El subnivel p aloja un máximo de 6 electrones.
El subnivel d aloja un máximo de 10 electrones.
El subnivel f aloja un máximo de 14 electrones.
Ejemplos de configuración electrónica
Para resolver algún ejercicio de configuración electrónica, es necesario que tengas a la mano el número atómico del elemento que tengas que estudiar, recuerda que el número atómico es el número de protones que hay en el núcleo del átomo de un elemento y se representa con la letra Z.
En este caso vamos a estudiar al Bromo.
Su número atómico es 35.
El Bromo tiene 35 protones y como es neutro también tiene 35 electrones.

1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d10 4pd5 donde observamos que no se completa el orbital 4p.
En este segundo ejemplo tomaremos como ejemplo el Hierro, su Z: es de 26

Para saber en qué periodo se encuentra y a cuál grupo pertenece debemos saber dos cosas:
1- Para el periodo: El número más alto que se encuentra antes de las letras, ya sea s,p,d,f nos va a indicar el número del periodo al cual pertenece el elemento.
1s2 2s2 2p6 3s2 3p6 4s2 3d6
En el caso del hierro es 4.
2- Para el grupo: Se deben sumar los últimos 2 números que están después de las letras ya sea s,p,d,f.
1s2 2s2 2p6 3s2 3p6 4s2 3d6 2+6 = 8 pero este número se debe escribir en romano, es decir VIII y al lado debe ir la letra correspondiente del grupo, el cual se determina de la siguiente forma: Si la última letra de la configuración es s o p será A, si la última letra es d o f será B.
Entonces para el hierro sería:
Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Periodo 4
Grupo VIIIB
En resumen…
La Configuración Electrónica de los elementos se define como la disposición de todos los electrones de un elemento en los niveles y subniveles energéticos u orbitales. El llenado de estos orbitales se produce en orden creciente de energía, es decir,de menor energía a mayor energía.
También es pertinente recordar que los orbitales son las regiones alrededor del núcleo de un átomo donde hay mayor probabilidad de encontrar los electrones.
