La formación del enlace iónico se produce cuando un elemento muy electropositivo se encuentra en las proximidades de uno muy electronegativo, es decir, uno situado a la izquierda de la tabla periódica con otro situado a la derecha a diferencia del enlace covalente.
Los científicos se basaron en múltiples definiciones para lograr un consenso y poder llegar a uno y decir que el enlace químico es un enlace que va más allá de lo complejo; por consiguiente, al discutir el enlace químico se usan las esencias de los modelos, que resultan mucho más simples y útiles para lo cual fueron realizadas.

Definición de enlace iónico
Mapa del artículo
En un enlace iónico se unen un metal y un no metal, entre los cuales existe una gran diferencia de electronegatividad. Si nos fijamos que en un enlace iónico, apoyandonos con la regla del octeto, existe una transferencia de electrones y posteriormente una atracción electrostática.
Los metales tienden a perder electrones, porque son electropositivos y los no metales tienden a ganarlos por ser electronegativos, de forma tal que cuando un metal se encuentra con un no metal se producirá una transferencia de electrones, o sea el metal cede electrones al no metal, el más electropositivo cede electrones al más electronegativo.
Con dicha formación de iones positivos, cationes, y negativos, aniones, se produce una atracción electrostática entre ambos regida por la ley de coulomb, la cual los mantendrá unidos.
La existencia de una gran cantidad de estos iones hace que se produzca una posterior estructuración sólida en forma de red cristalina de cationes y aniones, al producirse una atracción de tipo culombiana.
Si miramos que hay redes cristalinas en lugar de moléculas se puede justificar que energéticamente se ha comprobando cómo se desarrolla este procedimiento en el cual se forma el enlace iónico: considerando las etapas de transferencia electrónica, y vemos que energéticamente el sistema no se estabiliza, sino todo lo contrario.
¿Cómo se produce un enlace iónico?
Un enlace iónico no se produce solamente mediante el “robo o atrapamiento” de electrones, entre los diferentes elementos químicos, eso solo produce iones. Es la atracción culombiana entre los iones formados la que da lugar al enlace.
No hay unión específica entre el átomo que ha captado el electrón y el que lo ha cedido, tomando en cuenta que todos los electrones giran en torno a su núcleo, explicado en el modelo de bohr.
Solo existen interacciones y atracciones entre todos los iones de un signo determinado y todos los del otro y repulsiones entre todos los del mismo signo.
Un enlace se considera iónico cuando la diferencia de electronegatividades entre los elementos que se unen es mayor a 1.8
Electrovalencia
Podemos definir a la electrovalencia o valencia iónica como el número de electrones intercambiados por cada elemento en un enlace iónico. Es decir, es el número de electrones que un elemento gana o pierde para transformarse en un ion.
En el proceso de unión de estos iones para formar un mol de compuesto iónico se liberará una energía exactamente igual. Esta energía es una buena medida de la estabilidad de los compuestos iónicos.
Ciclo de Born-Haber y energía reticular
Es un ciclo termodinámico en el que se estudian, desde un punto de vista energético, todos los procesos que intervienen en la formación de un compuesto iónico a partir de sus elementos en sus estados termodinámicos más estables.
La energía reticular es la energía que se desprende al formarse un mol de cristal iónico a partir de sus iones componentes en estado gaseoso. Un cristal iónico será, por tanto, más estable cuanto mayor sea su energía reticular.
Esta es la formula de energia reticular:
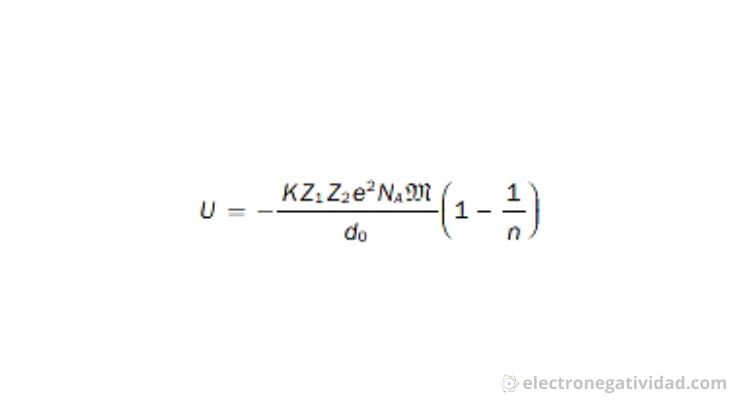
Donde la K se refiere a la constante de Coulomb en el vacío, la Z1 y Z2 son las cargas de los iones, la e es el valor absoluto de la carga del electrón, la NA el numero de avogadro, d0 distancia internuclear, la M es la constante de Mandelung que va a depender del tipo de red cristalina, y por ultimo la n es es el coeficiente de Born.
Resumiendo…
Un enlace iónico o electrovalente se define como el resultado de la presencia de atracción electrostática que existe entre los iones de distinto signo, es decir positivo y negativo, respecto a las valencias de los elementos y al número de electrones que son capaces de perder o ganar para completar cada uno la formación de sus capas, es decir, uno fuertemente electropositivo y otro fuertemente electronegativo.
Solo existen interacciones y atracciones entre todos los iones de un signo determinado y todos los del otro y repulsiones entre todos los del mismo signo.
Un enlace se considera iónico cuando la diferencia de electronegatividades entre los elementos que se unen es mayor a 1.8, es decir que los elementos con electronegatividad superior a 1.8 tienden a formar enlaces iónicos.

tadalafil
tadalafil