Los enlaces químicos, son fuerzas que mantienen unidos a los átomos dentro de los compuestos. Se dividen en varias clases, según las propiedades de los compuestos. Los dos tipos principales son: Enlace covalente y Enlace iónico. Estos dos tipos de enlaces son extremos y todos los enlaces tienen algo de ellos.
La comprensión de la naturaleza del enlace covalente es uno de los objetivos principales de la química. El enlace es la clave de la estructura molecular que a su vez está íntimamente ligada a las propiedades físicas y químicas de los compuestos.
Las actuales teorías permiten predecir estructuras y propiedades que suelen ser exactas (aunque no siempre son enteramente satisfactorias, al fin y al cabo son teorías).
Debemos recordar que las teorías propuestas siempre han de ser congruentes con los hechos experimentales. Si no hay concordancia entre teoría y hechos, la primera habrá de modificarse a fin de tomar en cuenta los hechos conocidos. Mencionaremos dos de estas teorías que explican la naturaleza del enlace químico y analizaremos una de ellas en más detalles.
El enlace covalente
Mapa del artículo
Un enlace covalente se forma cuando dos átomos comparten uno o más pares electrónicos. La mayoría de estos enlaces abarcan dos, cuatro o seis electrones, es decir, uno, dos o tres pares electrónicos. Así, dos átomos forman un enlace covalente sencillo cuando comparten un par de electrones ( molécula de hidrógeno; H2) un doble enlace cuando comparten dos pares electrónicos (molécula de oxígeno, O2) y un triple enlace cuando comparten tres pares electrónicos ( molécula de nitrógeno, N2).
Los enlaces covalentes pueden ser polares o no polares:
En los enlaces no polares, como los de las moléculas de Cloro, Oxígeno y Nitrógeno, los electrones son compartidos igualmente por los dos núcleos de las moléculas. Esto significa que los electrones compartidos son atraídos de la misma manera hacia los dos núcleos de los respectivos átomos, y que, por consiguiente, permanecen el mismo tiempo cerca de un núcleo que de otro. Dicho de otra forma, en los enlaces covalentes no polares la densidad electrónica es simétrica respecto de un plano perpendicular al eje internuclear.
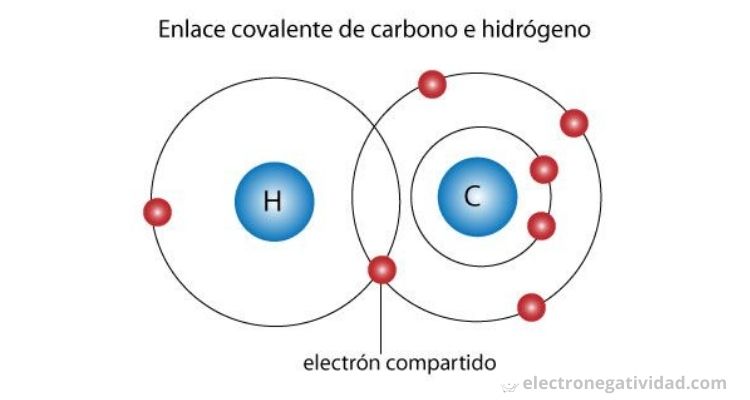
Por otro lado el enlace covalente polar, los electrones del enlace no se comparten por igual entre los dos núcleos. Aparece siempre que exista diferencia en los valores de electronegatividad de los átomos enlazados y, por tanto, casi siempre que los dos átomos sean diferentes. Hay casos como el enlace C-H, en el que el enlace se puede considerar casi como covalente puro dadas las electronegatividades similares entre los dos átomos ( 2,6 y 2,2 para el C y el H, respectivamente)
Las uniones simples, dobles y triples también se forman entre heteroátomos. El caso más simple es la unión entre cuatro átomos de hidrógeno, H (Z = 1) y un átomo de carbono, C, (Z = 6). El átomo de H necesita compartir 1 e- para tener configuración 1s2 del He, y el átomo de carbono necesita compartir con cuatro electrones (uno de cada átomo de H) para tener 8 e- en su capa más externa (regla del octeto).
Regla del octeto
Se aplica cuando un átomo diferente del hidrógeno tiende a formar enlaces hasta que se rodea de ocho electrones de valencia, es decir que se forma un enlace covalente cuando no hay suficientes electrones para que cada átomo individual complete su octeto. Al compartir electrones en un enlace covalente, cada átomo completa su octeto.
En el caso del hidrógeno, el requisito es que obtenga la configuración electrónica del helio o un total de dos electrones .
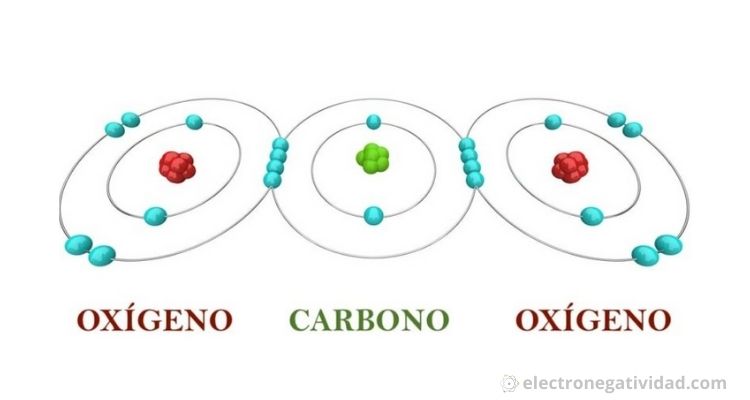
La regla del octeto funciona principalmente para los elementos del segundo periodo de la tabla periódica.
Estos elementos sólo tienen subniveles 2s y 2p, en los que puede haber un total de ocho electrones.
Cuando un átomo de uno de estos elementos forma un compuesto covalente, obtiene la configuración electrónica de gas noble (Ne) compartiendo electrones con otros átomos del mismo compuesto, debemos recordar que de los gases nobles solo el kriptón, radón y xenón poseen capacidad para captar electrones, como ejemplo de electronegatividad.
Momento dipolar
El momento dipolar, µ, se define como el producto de la carga en cualquiera de los extremos del dipolo, Q; por la distancia, r, entre las cargas: µ = Qr. (separación de cargas producida dentro de cada molécula). Por consiguiente, el momento dipolar se incrementa si la magnitud de las cargas que están separadas aumenta, si aumenta la distancia entre los centros positivo y negativo.
Los momentos dipolares se reportan en unidades debyes, D. Un debye es 3,33 x 10-30 coulombs-metro (C-m).
El momento dipolar es una cantidad vectorial, es decir, tiene tanto magnitud como dirección.
El momento dipolar total de una molécula poliatómica es la suma de sus dipolos de enlace. En esta suma se deben considerar tanto la magnitud como la dirección de los dipolos. Los dos dipolos de enlace del CO aunque son de igual magnitud, son de dirección exactamente opuestos, por consiguiente al sumarlos se cancelan entre sí, y el momento dipolar es cero.
Teoría de enlace de valencia
Anteriormente describimos que los enlaces covalentes son el resultado de la superposición de orbitales atómicos de dos átomos, considerándose así como el eje fundamental de la teoría de enlace de valencia.
Los electrones que forman un enlace no son estáticos, sino que se ubican preferentemente en una zona determinada. Si el enlace covalente se forma significa que los electrones de enlace están ubicándose con mucha más frecuencia dentro de una zona situada entre ambos átomos.
De esta forma se aminoran las repulsiones electrostáticas entre ambos núcleos, disminuyendo la energía del sistema.
La superposición de dos orbitales atómicos, que contienen electrones de valencia, da lugar a un orbital molecular localizado o de valencia. Como los dos electrones, que inicialmente estaban en orbitales separados, van a ocupar el mismo orbital deben tener espines opuestos, según el Principio de Exclusión de Pauli.
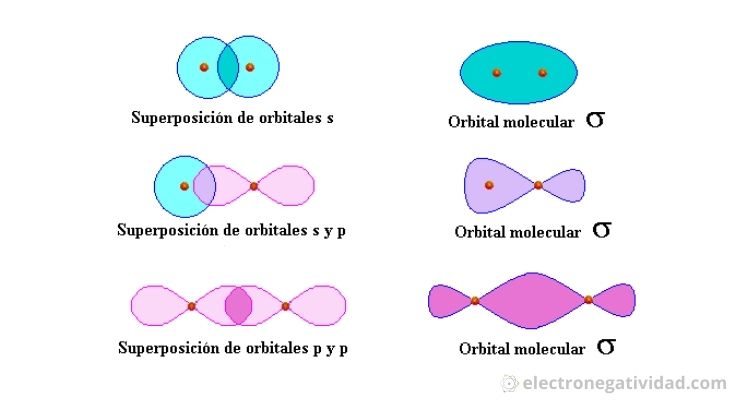
El enlace será tanto más fuerte cuanto mayor sea la superposición de orbitales. Por esta razón, las superposiciones frontales producen mayor estabilidad en la molécula que las laterales.
La superposición a lo largo de un mismo eje da lugar a enlaces de tipo sigma (σ) y la superposición a lo largo de ejes paralelos, a enlaces de tipo pi (π). En los enlaces σ la máxima densidad electrónica se encuentra sobre el eje que une ambos núcleos, en cambio, en los enlaces π, la máxima densidad electrónica se encuentra sobre y bajo un plano que contiene a dicho eje, a este plano, en el cual la probabilidad de encontrar un electrón es cero, se le denomina plano nodal.
En general podemos considerar que los enlaces sencillos son uniones σ. Un doble enlace consiste en una unión σ y una unión π, y un enlace triple consiste en un enlace σ y dos enlaces π.
