Sabemos que la electronegatividad se define como a la atracción que ejercen los átomos hacia los electrones que conforman un enlace químico, es decir, la tendencia que tienen los átomos para atraer a los electrones y formar un enlace, y para calcularla tenemos que hacerlo de manera indirecta, a través de la escala de Pauling, la diferencia de electronegatividad para saber el tipo de enlace que se forma y repasar la tabla periódica para saber cómo se organiza en esta.
Comencemos con la escala de Pauling
En esta escala los valores van desde el 0,7 para el elemento menos electronegativo hasta el 4,0 para el más electronegativo. A continuación mostremos como se usa dicha escala de manera didáctica para la práctica.
Tres ejemplos de electronegatividad explicados paso a paso
Mapa del artículo
Ejemplo 1 electronegatividad:
Consultando la tabla de electronegatividades, debemos ordenar los siguientes enlaces según su polaridad creciente, e indicar si alguno de ellos es iónico:
| XA – XB= ∆1/2 |
Utilizando la fórmula propuesta por Pauling donde Δ representa la energía de resonancia iónica covalente.
Bien, lo primero que tenemos que hacer es ubicar en la tabla periódica el valor de electronegatividad de cada uno de estos elementos.
| Elementos | Electronegatividad |
| Be-Cl | 1.5-3.0 |
| C-I | 2.5- 2.5 |
| Ba-F | 0.9-4.0 |
| Al-Br | 1.5-2.8 |
| S-O | 2.5-3.5 |
| P-Cl | 2.1-3.0 |
| C-O | 2.5-3.5 |
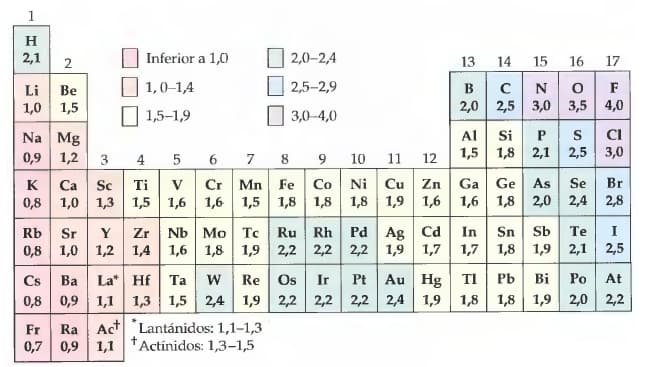
Una vez que tenemos los valores, procedemos a calcular la diferencia electronegativa para determinar su polaridad creciente.
1) Be-Cl El berilio (1.5) tiene un valor electronegativo menor que el cloro (3.0) entonces se sugiere colocar el número mayor primero para que los resultados sean positivos y no generen confusión alguna.
3.0-1.5 = 1.5
Ahora bien, nos ubicamos en la diferencia de electronegatividad que nos dice que:
- Si el valor es mayor a 1.7 se habla de que el enlace de esa molécula es iónico.
- Si el valor es menor a 1.7 se habla de que el enlace de esa molécula es covalente polar.
- Si el valor es menor a 0.5 se habla de que el enlace de esa molécula es covalente no polar.
Siendo así que para el Be-Cl la diferencia de electronegatividad es 1.5 y este es menor a 1.7, este forma un enlace covalente polar.
2) C-I
2.5- 2.5 = 0 la diferencia de electronegatividad es 0 y este es menor a 0.5, lo que nos dice que el enlace es covalente no polar.
3) Ba-F
4.0-0.9 = 3.1 la diferencia de electronegatividad mayor a 1.7 y por tanto el enlace de esa molécula es iónico.
Las resoluciones de estos ejercicios son muy fáciles y nos ayudan a comprender como es el comportamiento de los átomos en un compuesto acercandonos también a comprender el modelo atómico de bohr, así como determinar su polaridad del tipo de enlace que forma.
Pauling propuso que, para una diferencia de electronegatividad de 1,7, el enlace tiene aproximadamente un 50% de carácter iónico; si la diferencia es mayor, el enlace es fundamentalmente iónico, y si es menor, covalente.
¿Cómo se ordenan los elementos según su electronegatividad?
Pues muy sencillo, se ordenan del más electronegativo al más electropositivo.
Para saber eso debemos utilizar la tabla periódica. Tomaremos los datos que utilizamos en el ejemplo anterior porque ya tenemos sus valores.
Ejemplo 2 electronegatividad:
- Be-Cl- C-I -Ba-F = F > Cl > C > I > Be > Ba
- Al-Br S-O- P-Cl –C = O > Cl > Br > C > S > P > Al
Así se ordenan de una manera pedagógica, pero su orden en la tabla periódica es diferente, se ubican según su valor de electronegatividad, de izquierda a derecha aumentan en un mismo periodo y en un grupo aumentan de abajo hacia arriba, también es válido decir que disminuye de arriba hacia abajo

Podemos calcular cuál enlace tiene mayor diferencia de electronegatividad
Ubicamos el valor de electronegatividad de los siguientes elementos en la tabla periódica y realizamos el mismo procedimiento aplicado anteriormente con la fórmula de Pauling.
Ejemplo 3 electronegatividad:
a) SrCl2 = 1.3, 3.0 (3.0-1.3) = 1.7 50% de carácter iónico.
b) PCl3 = 2.1, 3.0 (3.0-2.1) = 0.9 Según las proposiciones de Pauling
c) NH3 = 3.0, 2.1 (3.0-2.1) = 0.9 estos enlaces son covalentes
d) LiCl = 1.0, 3.0 (3.0- 1.0) = 2.0 enlace fundamentalmente iónico.
Ahora, nos ubicamos en la diferencia de electronegatividad que nos dice que:
- Si el valor es mayor a 1.7 se habla de que el enlace de esa molécula es iónico.
- Si el valor es menor a 1.7 se habla de que el enlace de esa molécula es covalente polar.
- Si el valor es menor a 0.5 se habla de que el enlace de esa molécula es covalente no polar
Pauling propuso que, para una diferencia de electronegatividad de 1,7, el enlace tiene aproximadamente un 50% de carácter iónico; si la diferencia es mayor, el enlace es fundamentalmente iónico, y si es menor, covalente.
Para explicarlo de una forma más sencilla, el átomo de cloro en el ejercicio a) del ejemplo 3, tiene una electronegatividad mayor que el átomo de estroncio, por lo que los electrones de enlace estarán más cerca de la Cl.
Lo mismo aplicaríamos a cada uno de los ejemplos mostrados, para tener una idea clara del porqué un átomo forma un determinado enlace y su capacidad de atraer electrones, o sea, nos ayuda a estudiar el comportamiento del átomo y del enlace que forma.
¿Qué aprendimos?
- El concepto de electronegatividad
- El orden de los elementos de forma creciente y que en la tabla periódica se ordena de una forma que estableció Linus Pauling.
- A calcular la diferencia de electronegatividad mediante la fórmula de Pauling y a determinar el tipo de enlace que forma.
- Que el comportamiento de los átomos, la capacidad de atracción que posean y el enlace que formen orientándonos con la escala de electronegatividad.
- También que el uso de la tabla periódica es imprescindible para poder resolver los ejercicios en la práctica.
Es importante reconocer que el estudio aplicado y con esfuerzo nos llevará a tener un mejor desempeño y que las dificultades para entender algo no es el límite para mejorar sino para tener paciencia y tomarse el tiempo y dedicación de querer aprender.
