La estructura de Lewis la podemos definir como la forma en la que se representan los enlaces de los electrones de valencia que se muestran con puntos, el cual cada átomo forma el conjunto de enlaces de forma tal que puedan rodearse de los ocho puntos, o electrones, es decir cumpliendo la regla del octeto. En dicha estructura cada uno de los electrones podrían estar compartiendo y formando parte del enlace covalente o también no estar compartidos y son los que llamamos solitarios o no enlazantes. En el caso de las uniones iónicas no sucede igual.
Reglas de la estructura de Lewis
Mapa del artículo
La estructura de Lewis correcta se suele hacer por simple intuición o incluso porque la recordamos bien, pero en el caso contrario, que no sepamos, existen reglas que nos ayudarán a realizar correctamente la estructura:
- Elegir el átomo central, que en general es menos electronegativo, a excepción del hidrógeno H y el más electronegativo es el flúor F, que siempre serán terminales porque solo logran formar un solo enlace. En el caso de los compuestos que son orgánicos siempre será el carbono C (excepto en los éteres).
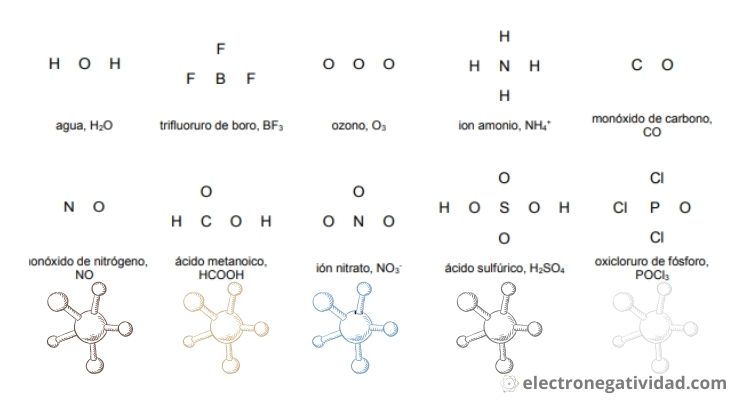
Se muestra que para formar la estructura de Lewis, algunos átomos serán terminales y otros centrales como en el caso de la molécula de agua H2O, que los átomos de hidrógeno son terminales y el oxigeno es central. - Alrededor del átomo central se van a situar los demás (enlazados) de una forma simétrica, lo más simétrico posible. En los oxoácidos, generalmente el hidrógeno H se une al oxígeno O. (En el monóxido de carbono CO y el óxido nítrico NO, el carbono C y el nitrógeno N respectivamente son centrales).
- Ahora viene la parte de los números, pues para calcular el número total de electrones de valencia de todos los átomos que representamos con la estructura de Lewis, solo tenemos que ir añadiendo la carga neta si es que la hay, por ejemplo: si la carga neta es -2, añadir dos electrones; si la carga neta es +1, restar un electrón.
Y así vamos a tener el número total de electrones para poder asignar los enlaces y átomos. - Bien, lo que sigue será dibujar un enlace entre cada par de átomos que se encuentran conectados, asignando a cada enlace un par de electrones que vamos a ir restando del total.

De esta forma quedarán las moléculas según su estructura de Lewis
Entonces debemos comenzar por los enlazados y terminar en el átomo central, y luego asignar los electrones restantes, en forma de pares, a cada átomo hasta que este tenga la capa cerrada.
El hidrógeno H cierra con 2. En general los átomos centrales del 2º período cierran con 8 electrones, excepto el berilio Be con 4 y el boro B con 6.
Si hay algún electrón sin par este se representa con un solo punto, que se debe situar justo en el átomo central demostrando que en este caso la molécula tiene momento magnético y es paramagnética.
Ecuación para obtener las estructuras de Lewis
La estructura de Lewis representa la disposición espacial de los electrones de las moléculas, pero es necesario el uso de ecuaciones y reglas ya mencionadas, para poder saber asignar los electrones, más no nos puede indicar el nivel de electronegatividad en la tabla periódica.
Electrones compartidos= Electrones necesarios– Electrones disponibles
Electrones necesarios= Que no son más que los que se debe llegar cada elemento, siempre 8 recordando que en el caso del hidrógeno H son 2
Electrones disponibles= Son los que tienen capa de valencia.

Recuerda que es importante que tengamos en cuenta que en esta forma cada átomo que compone cada parte de la estructura, colocar bien los electrones según la suma o resta de electrones.
Para electrones solitarios o impares es la siguiente fórmula :
Electrones solitarios= Electrones disponibles–Electrones compartidos
¿Para qué sirve la estructura de Lewis?
La estructura de Lewis nos sirve para representar de una forma gráfica y espacial todos los compuestos o elementos que queramos estudiar y saber su capacidad de formar o no enlaces, con ayuda de las propiedades de la tabla periódica y conceptos básicos de electronegatividad y enlaces químicos.
